Las
enzimas son catalizadores biológicos selectivos de una eficiencia
extraordinaria. Toda célula viva dispone de cientos de enzimas distintas que
catalizan las reacciones esenciales para la vida.
El
papel principal de las enzimas es aumentar las velocidades de tales reacciones.
Las enzimas pueden hacer más que sólo aumentar la velocidad de una sola
reacción muy específica. Algunas también pueden combinar, o acoplar, dos
reacciones que normalmente serían separadas. Esta propiedad permite que la
energía ganada en una reacción se use en una segunda reacción. Un catalizador
es una sustancia que acelera la llegada a un equilibrio. Un catalizador puede
cambiar en forma temporal durante la reacción, pero no cambia en el proceso
general, porque se recicla para participar en varias reacciones.
El
nombre enzima deriva de una palabra griega que significa “en la levadura”.
Indica que dichos catalizadores están presentes en el interior de las células.
A finales del siglo XIX se estudió la fermentación de los azúcares por acción
de células de levadura.
Clases
de enzima:
ª Oxidorreductasas:
Estas catalizan las reacciones de oxidación-reducción. La mayor parte de esas
enzimas se llaman, en general, deshidrogenasas. También hay otras llamadas
oxidasas, peroxidasas, oxigenasas o reductasas.
ª Transferasas:
encargadas de catalizar las reacciones de transferencia de un grupo y pueden necesitar
la presencia de coenzimas.
ª Hidrolasas:
clase especial de transferasas donde el agua sirve como aceptor del grupo
transferido. La pirofosfatasa es un ejemplo sencillo de una hidrolasa.
ª Liasas:
catalizan la división de C—C, C—O, C—N y otros enlaces mediante eliminación de
átomo, dejando dobles enlaces.
ª Isomerasas:
catalizan cambios geométricos o estructurales dentro de una molécula.
ª Ligasas:
catalizan
la unión de dos moléculas acopladas a la hidrólisis de ATP.
Experimentos
cinéticos que revelan las propiedades de las enzimas
1. Cinética Química: se examina la relación
entre la cantidad de producto (P) que se forma en una unidad de tiempo y las condiciones experimentales bajo las que
se efectúa la reacción. La base de la mayor parte de las mediciones cinéticas
es la observación de la rapidez, o velocidad (
), de una reacción, la cual varía en forma
directa con la concentración de cada reactante. Esta observación se expresa en una
ecuación de velocidad.
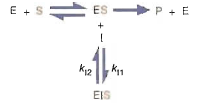
2. Cinética enzimática: Los primeros
estudios de cinética enzimática confirmaron que una enzima (E) se une a un
sustrato para formar un complejo enzima-sustrato (ES). Los complejos ES se
forman cuando los ligandos se unen de manera no covalente a sus lugares
adecuados en el sitio activo. El sustrato reacciona en forma transitoria con la
proteína catalizadora (y con otros sustratos, en una reacción multisustratos)
para formar el producto de la reacción. Esta reacción se efectúa en
dos pasos distintos: la formación del complejo enzima sustrato y la reacción
química actual, acompañada por la disociación del producto.
Ecuación de Michaelis- Menten
Las
reacciones pueden ser descritas matemáticamente mediante ecuaciones de
velocidad. Las primeras ecuaciones de velocidad fueron deducidas a principios
de 1900.
La ecuación
de Michaelis-Menten ilustra en términos
matemáticos la relación entre la velocidad de reacción inicial V1 y
la concentración de sustrato [S].
La
constante Km de Michaelis es la concentración de sustrato a la cual
V1 es la mitad de la velocidad máxima (Vmax/2) alcanzable
a una concentración particular de enzima.
1.
Cuando [S] es mucho menor que el término Km
+ [S] es en esencia igual a la Km. En
otras palabras, cuando [S] está muy por debajo de Km, V1
es proporcional a k [S]. Por ende, la velocidad de reacción inicial es
directamente proporcional a [S].
2.
Cuando
[S] es mucho mayor que Km el término Km + [S] es en esencia igual a [S].
3. Cuando
[S] = Km
Deducción de la ecuación de
Michaelis-Menten
Una
deducción común de la ecuación de Michaelis-Menten, debida a George E. Briggs y
J. B. S. Haldane, es llamada la derivación del estado estable. Esta deducción
postula que hay un intervalo de tiempo (llamado estado estable, o estado
estacionario) durante el cual se forma el complejo ES a la misma velocidad con
la que se descompone, de modo que la concentración de ES es constante. La
velocidad inicial se usa en la derivación del estado estable porque se asume
que la concentración de producto ([P]) es insignificante.
Al
suponer que la concentración de ES en estado estable es constante, entonces la velocidad
de formación de producto depende de la velocidad de la reacción química y de la
velocidad de disociación de P para abandonar la enzima. El paso limitante de la
velocidad es hacia el lado derecho de la reacción y la velocidad depende de la constante de
velocidad k2 y de la concentración de ES.
B.
Constante catalítica kcat
Cuando
la concentración de sustrato es alta, la velocidad total de la reacción es Vmáx
y está determinada por la concentración de la enzima. La constante de velocidad
observada bajo estas condiciones se llama constante catalítica, Kcat,
y se define como sigue:
Donde
kcat representa la cantidad de moles de sustrato convertidos en
producto, por segundo y por mol de enzima (o por mol de sitio activo, para una
enzima con multisubunidades) bajo condiciones de saturación. En otras palabras,
kcat indica la cantidad máxima de moléculas de sustrato convertidas
en producto cada segundo por cada sitio activo. A eso se le llama con
frecuencia número de recambio. La constante catalítica mide la rapidez
con que determinada enzima puede catalizar una reacción específica; es una
forma muy útil para describir la eficacia de una enzima. La unidad de kcat
es s-1. El recíproco de kcat es el tiempo necesario para
que haya un evento catalítico.
Significados de Km
La
constante de Michaelis tiene varios significados. La ecuación siguiente define
a Km como la relación de las constantes de velocidad combinadas para
la descomposición de ES dividida entre la constante para su formación.
Medición de Km y Vmáx
Los
parámetros cinéticos de una reacción enzimática pueden producir información
valiosa acerca de la especificidad y el mecanismo de la reacción. Los
parámetros clave son Km y Vmáx ya que kcat se puede calcular si se
conoce Vmáx.
Los
datos de Km y Vmáx para una reacción catalizada por
enzima se pueden determinar de diversas maneras. Es posible obtener ambos
valores por análisis de las velocidades iniciales en una serie de
concentraciones de sustrato y una concentración fija de enzima. Para obtener
valores fiables de las constantes cinéticas, los puntos de [S] se deben
extender por abajo y por arriba de Km para producir una hipérbola. Es difícil
determinar Km o Vmáx en forma directa con una gráfica de
velocidad inicial en función de la concentración porque la curva tiende a la Vmáx
en forma asintótica. Sin embargo, se pueden determinar valores exactos usando
un programa de cómputo adecuado para ajustar los resultados experimentales a la
ecuación de la hipérbola.
La
ecuación de Michaelis-Menten se puede reacomodar para obtener valores de Vmáx
y Km a partir de líneas rectas en gráficas.
Cinética de las reacciones con sustratos
múltiples
Las
mediciones cinéticas de reacciones con sustratos múltiples son algo más
complicadas que para cinéticas enzimáticas sencillas con un solo sustrato.
Las
reacciones de multisustrato pueden efectuarse de acuerdo con varios y distintos
esquemas cinéticos llamados mecanismos cinéticos porque se deducen en su
totalidad mediante experimentos cinéticos. Los mecanismos cinéticos son
comúnmente representados con la notación introducida por W. W. Cleland.
Las
reacciones consecutivas (o secuenciales) requieren que todos los sustratos
estén presentes para que se libere algún producto. Estas reacciones secuenciales
pueden ser ordenadas, con un orden obligatorio de enlazamiento de sustratos y
de liberación de productos. También pueden ser aleatorias, sin orden
obligatorio de enlazamiento o liberación. En las reacciones ping-pong se libera
un producto antes de que se enlacen
todos los sustratos.
Inhibición enzimática
Los
inhibidores de las actividades catalíticas de enzimas proporcionan tanto
agentes farmacológicos como recursos de investigación para estudiar el
mecanismo de acción de las enzimas. La fuerza de la interacción entre un inhibidor
y una enzima depende de las fuerzas importantes en la estructura de proteína y
la unión de ligando (enlaces de hidrógeno, interacciones electrostáticas,
interacciones hidrofóbicas y fuerzas de van der Waals). Los inhibidores pueden
clasificarse con base en su sitio de acción en la enzima, en si producen
modificación química de la enzima, o en los parámetros de cinética sobre los cuales
influyen. Desde el punto de vista cinético, se distinguen dos clases de
inhibidores con base en si el aumento de la concentración de sustrato supera o
no la inhibición.
Muchos fármacos actúan como inhibidores
de enzimas:
El
objetivo de la farmacología es identificar agentes que pueden:
1.
Destruir o alterar el crecimiento, la invasividad o el desarrollo de agentes
patógenos invasores
2.
Estimular mecanismos de defensa endógenos
3.
Suspender u obstaculizar procesos moleculares aberrantes desencadenados por estímulos
genéticos, ambientales o biológicos, con trastorno mínimo de las funciones
celulares normales del huésped.
En
virtud de sus diversas funciones fisiológicas y alto grado de selectividad de
sustrato, las enzimas constituyen blancos naturales para la creación de
fármacos que son tanto potentes como específicos.
Inhibición competitiva
Los
efectos de los inhibidores competitivos pueden superarse al aumentar la
concentración de sustrato. Con mayor frecuencia, la inhibición competitiva del
inhibidor (I) se une a la porción de unión a sustrato del sitio activo, lo que
bloquea el acceso por el sustrato. Por ende, las estructuras de casi todos los
inhibidores competitivos clásicos tienden a asemejarse a las estructuras de un
sustrato y, así, se llaman análogos de
sustrato.
Un
inhibidor competitivo actúa al disminuir el número de moléculas de enzima
libres disponibles para unión a sustrato, esto es, para formar ES y, así,
finalmente para formar producto, un inhibidor competitivo y
sustrato ejercen efectos recíprocos sobre la concentración de los complejos EI
y ES.
Inhibidores Acompetitivos
En
la inhibición acompetitiva, el inhibidor sólo se une al complejo enzima-sustrato,
y no a la enzima libre.La Inhibición acompetitiva suele observarse en las reacciones
en las que las enzimas unen más de un sustrato.
Inhibidores
no competitivos
En algunas reacciones catalizadas por enzimas el
inhibidor puede unirse tanto a la enzima como al complejo enzima-sustrato:
En
estas circunstancias, que se denominan inhibición no competitiva, el inhibidor
se une a un lugar diferente del lugar activo. La unión del inhibidor ocasiona
la modificación de la conformación de la enzima que impide la formación del
producto.
Normalmente,
los inhibidores no competitivos no afectan a la unión del sustrato y se parecen
poco o nada a éste. Como con los inhibidores acompetitivos, la inhibición no competitiva
sólo se invierte parcialmente aumentando la concentración de sustrato.
.
Inhibición
irreversible
La
inhibición puede ser reversible o irreversible. En la inhibición reversible (es
decir, inhibición competitiva, acompetitiva y no competitiva), el inhibidor
puede disociarse de la enzima debido a que se une mediante enlaces no covalentes. Los
inhibidores irreversibles normalmente se unen covalentemente a la enzima, con
frecuencia a una cadena lateral del lugar activo.
Enzimas alostéricas
Las
enzimas alostéricas son enzimas cuyas propiedades son afectadas por cambios en
la estructura. Los cambios estructurales son ocasionados por interacción con
moléculas pequeñas. Con frecuencia, las enzimas alostéricas no presentan cinética
clásica de Michaelis-Menten debido a su unión cooperativa del sustrato, como el
caso de la hemoglobina, que no es enzima.
Propiedades generales de las enzimas
alostéricas
1. Las
actividades de las enzimas alostéricas cambian debido a inhibidores y activadores
metabólicos.
2. Los
moduladores alostéricos se enlazan en forma no covalente a las enzimas que regulan.
3. Con
pocas excepciones, las enzimas reguladoras son proteínas de subunidades múltiples.
4. Toda
enzima sujeta a regulación alostérica posee cuando menos un sustrato para el
cual la curva de VO en función del [S] es sigmoidea en lugar de
hiperbólica.











No hay comentarios:
Publicar un comentario